посилання на онлайн підручник - https://pidruchnyk.com.ua/469-hmya-yaroshenko-11-klas.html
Роботи надсилайте на Viber 0668804185 ,або електронну адресу kukalosveta1990@gmail.com
12.01.2023
Тема"Загальні поняття про біологічно активні речовини" - переглнути відео урок, виписати головне.Вивчити
https://www.youtube.com/watch?v=2IGJlhVbiRY
БІОЛОГІЧНО АКТИВНІ РЕЧОВИНИ
Біологічно активні речовини (БАР) – це неорганічні ύ органічні сполуки, загальною особливістю яких є висока активність у невеликих кількостях. Серед біологічно активних речовин є як низькомолекулярні (наприклад, вітаміни, алкалоїди), так і високомолекулярні сполуки (наприклад, ферменти, білкові гормони). Загальною особливістю є висока активність у невеликих кількостях. Більшість БАР відносять до продуктів вторинного обміну, вважаючи первинними білки, ліпіди й вуглеводи. Вони не виконують ні будівельної, ні енергетичної функції, а забезпечують зміну швидкості обміну речовин, пристосовуючи організм до змін навколишнього середовища та здійснюють його захист від несприятливих впливів. До біологічно активних речовин відносять ферменти, гормони, фітогормони, вітаміни, фітонциди, алкалоїди, феромони, антибіотики та ін.
17.01.2023
Тема" Роль органічної хімії у розвєязання сировинної , енергетичної проблем" - опрацювати параграф 34 ст.193-198. Дати відп на питання на ст 197-198
Посилання на онлайн підручник - https://pidruchnyk.com.ua/380-himiya-yaroshenko-10-klas.html
19.01.2023
Тема" Вітаміни та ферменти" - опрацювати параграф 33 ст.187.
Посилання на онлайн підручник - https://pidruchnyk.com.ua/380-himiya-yaroshenko-10-klas.html§ 33. Вітаміни й ферменти
ПОНЯТТЯ ПРО ВІТАМІНИ. Якщо до цього ми об'єднували органічні речовини в групи чи класи, враховуючи спільне в їх будові та властивостях, то виокремлення групи вітамінів відбулося по-іншому. У них різна будова, не схожі хімічні властивості, але спільне значення (біологічна роль) у живій природі.
Вітаміни — низькомолекулярні органічні сполуки різних класів з відносною молекулярною масою (від кількох десятків до кількох сотень), які в невеликих кількостях, але обов'язково потрібні для здійснення хімічних процесів в організмах.
Ще століття тому про вітаміни й гадки не мали, однак наслідки їх нестачі, що призводили до тяжких захворювань на рахіт, курячу сліпоту, цингу та деякі інші захворювання, були відомі.
Пригадайте з біології причини та симптоми цих захворювань.
Дослідження складу й властивостей вітамінів бере початок із праць Миколи Івановича Луніна. Учений експериментально довів, що для нормального функціонування організмів тварин і людини, крім білків, жирів і вуглеводів, необхідні інші, невідомі на той час, компоненти їжі. Після відкриття їх назвали вітамінами (vita — життя). Вчені виділили вітаміни в чистому вигляді, дослідили їхні будову й властивості, завдяки чому став можливим синтез вітамінів за межами організму, тобто їхнє промислове виробництво.
До групи вітамінів належить понад 20 органічних речовин природного походження й чимало їхніх синтезованих аналогів.
ітаміни, окрім назви, мають умовні позначення великими літерами латинського алфавіту, а деякі з них ще й числами. З позначеннями, назвами вітамінів та середньою добовою потребою дорослої людини в них ознайомтеся за таблицею 15.
Таблиця 15
Вітаміни | Середня добова норма | |
Позначення | Назва | |
С | Аскорбінова кислота | 100-200 мг (лікувальна доза до 2 г) |
В1 | Тіамін | 1,1-1,5 мг |
В2 | Рибофлавін | 1-3 мг |
В6 | Піридоксин | 2-2,2 мг |
В12 | Ціанокобаламін | 3 мкг |
РР | Ніацин, нікотинова кислота | 20-25 мг |
Закінчення таблиці 15
Позначення | Назва | Середня добова норма |
Н | Біотин | 150-200 мкг |
К | Нафтохінони | 0,5 мг |
А | Ретинол | 1 мг |
D | Кальциферол | 10-25 мкг |
E | Токоферол | 10 мг |
Наведені нижче для ознайомлення (не для запам'ятовування) формули свідчать, наскільки різноманітні склад і хімічна будова вітамінів.

Здебільшого у складі вітамінів наявні атоми Карбону, Гідрогену, Оксигену, Нітрогену. Проте існують вітаміни, якісний склад яких доповнений атомами інших хімічних елементів.
За здатністю розчинятися у воді вітаміни поділяють на водорозчинні (наприклад, С, РР, В1, В2) та жиророзчинні (наприклад, А, Е, K). Водорозчинні вітаміни не накопичуються в організмі людини, тому мають надходити до нього постійно. Для засвоєння жиророзчинних вітамінів у їжі мають бути жири.
БІОЛОГІЧНА РОЛЬ ВІТАМІНІВ. Вітаміни регулюють в організмі обмін речовин через систему ферментів, діють у комплексі з ними. І нестача навіть одного вітаміну є небезпечною, бо порушуються обмінні процеси, унаслідок чого розвиваються різного роду захворювання. Потреба у вітамінах кожної людини індивідуальна й залежить від віку, стану здоров'я й навіть пори року. Найбільше організм людини потерпає від нестачі двох вітамінів — С і В1.
У тому, що вітаміни потрібні в дуже малій кількості, переконує таке порівняння: маса добової норми вітамінів для дорослої людини буде меншою від маси однієї насінини проса.
Організм людини досить чутливий до вмісту в ньому кожного з вітамінів і йому однаково небезпечні як нестача, так і надлишок вітамінів. За нестачі розвивається захворювання на гіповітаміноз, за надлишку — на гіпервітаміноз. Стан, коли вітамін в організмі відсутній, називають авітаміноз. Організм людини так влаштований, що не синтезує більшості вітамінів, а тому надходження їх з їжею обов'язкове. З метою профілактики авітамінозу можна вдатися до вживання вітамінних препаратів — полівітамінів, одна пігулка яких досить часто містить не лише комплекс вітамінів, а й важливі неорганічні компоненти — мікроелементи.
Під час приготування й споживання страв потрібно пам'ятати, що недотримання правил зберігання продуктів харчування, порушення технології їх кулінарної обробки зменшують вміст біологічно активних речовин, особливо вітамінів.
Вітаміни — необхідний компонент складного процесу обміну речовин. Їх нестача позначається на самопочутті людини, працездатності, стійкості до різних захворювань.
З біологічною роллю окремих вітамінів ви ознайомилися в курсі біології. Ознайомтеся з джерелами надходження вітамінів до організму людини за малюнком 58.

Мал. 58. Джерела надходження вітамінів до організму людини
Вітамін С (аскорбінова кислота). Підвищує захисні сили організму, поліпшує еластичність судин, робить організм стійким до захворювань дихальних шляхів. Стимулює діяльність ендокринної й центральної нервової систем, сприяє кращому засвоєнню йонів Феруму й нормальному кровотворенню.
ФЕРМЕНТИ. Таку назву дістали біологічно активні речовини, що прискорюють хімічні реакції, пов'язані з обміном речовин і перетворенням енергії, синтезом ДНК і РНК в організмах. Тому їх ще називають біологічними каталізаторами.
Одні ферменти каталізують синтез сполук, інші — розщеплення. Наприклад, амілаза прискорює розщеплення крохмалю й глікогену, але не впливає на жири. А фермент ліпаза забезпечує розщеплення жирів, але не діє на полісахариди.
Усі ферменти вибагливі до температури та рН середовища. Одні з них активні в кислому середовищі (ферменти шлунку), інші — у слабколужному (ферменти слини).
Сторінка ерудита
Вам добре відоме застосування в кулінарії кухонної солі, оцту, соди, цукру, лимонної кислоти. У невеликій кількості їх додають до продуктів харчування задля поліпшення смаку, подовження терміну зберігання, зміни кольору й консистенції тощо. Звідси й назва — харчові добавки.
Для таких речовин у багатьох країнах світу, зокрема й Україні, розроблена система кодифікації з присвоєнням буквених кодів — Е-чисел.
Нумерацію харчових добавок розпочинають із числа 100. Серії «E» від 100 до 199 мають барвники, від 200 до 299 — консерванти, від 300 до 399 — антиоксиданти. Далі йдуть згущувачі, емульгатори, піногасники, підсилювачі смаку й аромату. Така класифікація є умовною, оскільки одна й та сама речовина може бути, скажімо, і консервантом, і антиоксидантом одночасно (наприклад, натрій сульфіт E 221). Переліки харчових добавок проходять спеціальне затвердження.
Сирокопчені ковбаси, вироби з вареного м'яса, молоко згущене, сири, ікра зерниста, креми, джеми, повидло, маргарин, майонез, безалкогольні напої, печиво, соки — це лише маленька частина нескінченно довгого переліку продуктів, у виготовленні яких застосовують різноманітні харчові добавки. Слід пам'ятати про можливі негативні наслідки для здоров'я людини харчових добавок у разі надмірного їх надходження в організм.
Стисло про основне
• Вітаміни й ферменти — важливі біологічно активні речовини. Вони впливають на перебіг хімічних процесів в організмах.
• Незважаючи на те, що в організмах міститься незначна кількість вітамінів і ферментів, їх роль надзвичайно важлива. Нестача вітамінів і ферментів призводить до розвитку різних захворювань.
• Збалансоване харчування дає можливість забезпечити організм людини достатньою кількістю вітамінів і ферментів.
Знаємо, розуміємо
- 1. Дайте визначення вітамінів, наведіть їх класифікацію та приклади.
- 2. Обґрунтуйте біологічну роль вітамінів, підтвердьте її прикладами.
- 3. Прокоментуйте вислів академіка В. О. Енгельгардта: «Вітаміни виявляють себе не своєю присутністю, а своєю відсутністю».
- 4. Наведіть приклади вітаміноносної рослинної й тваринної їжі.
26.01.2023
https://www.youtube.com/watch?v=SYsTFcvuvg4&t=347s - посилання на відео урок
Розташувавши всі відомі хімічні елементи в порядку зростання атомних мас, Менделєєв виявив, що властивості повторюються через певне число елементів.
Повторимо дії Менделєєва з урахуванням того факту, що благородні гази на той час ще не були відомі. Розташуємо елементи за зростанням атомної маси (другий рядок таблиці), вкажемо металічні та неметалічні властивості, формули і властивості вищих оксидів і гідроксидів, а також формули газоподібних сполук з Гідрогеном.
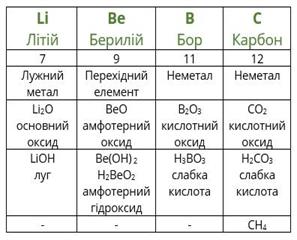
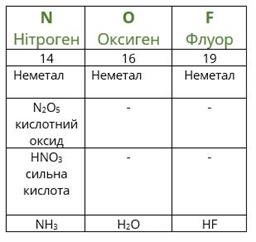
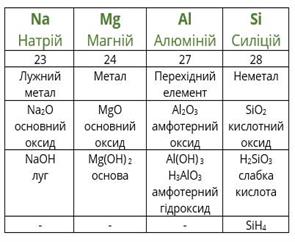
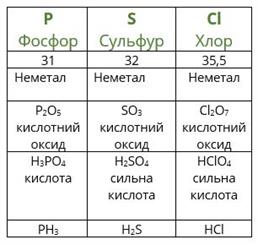
посилання на онлайн підручник - https://pidruchnyk.com.ua/469-hmya-yaroshenko-11-klas.html
Роботи надсилайте на Viber 0668804185 ,або електронну адресу kukalosveta1990@gmail.com
02.02.2023
Тема:Тема " Електронні і графічні електронні формули атомів s- p- d-елементів з урахуванням принципів "мінімальної енергії" - переглянути презентацію,виписати головне
07.02.2023
Тема"Електронні і графічні електронні формули атомів s- p- d-елементів з урахуванням принципів "мінімальної енергії"- переглянути відео урок, виписати головне, виконати завдання на ст 12 № 1-6
https://www.youtube.com/watch?v=xV3xsK22x_A&t=173s - посилання на відео урок
Тема " Збуджений стан атома"- переглянути відео урок, виписати головне
https://www.youtube.com/watch?v=dwGjKKDFrLE&t=201s - посилання на відео урок
09.02.2023
Тема " Валентні стани елементів. Можливі ступені окиснення ннеметалічних елементів2 і 3 періодів" - переглянути відео урок., опрацювати параграф 3 ст 18.На ст 21 виконати письмовр 1-3 пит.
посилання на онлайн підручник - https://pidruchnyk.com.ua/469-hmya-yaroshenko-11-klas.html
Роботи надсилайте на Viber 0668804185 ,або електронну адресу kukalosveta1990@gmail.com
https://www.youtube.com/watch?v=c9w3f-ftP2o&t=28s - посилання на відео урок
Тема " Електронні та графічні електронні формули атомів неметалічних елементів 2 і 3 періодів у основному і збудженому станах." - опрацювати конспект уроку
Хід уроку
1. «Логічний ланцюг»
Запишіть будову атомів неметалічних елементів 2 та 3 періодів. Вкажіть, що спільного та відмінного у будові атомів та можливі ступені окиснення.
2. «Відстрочена відгадка»
Елемент розташований у III періоді, VI групі, головній підгрупі періодичної системи. Який це елемент? Запишіть повну будову його атома в основному та збудженому станах, укажіть кількість неспарених електронів. Передбачте його валентність та можливі ступені окиснення.
3. «Приваблива мета»
Дано елементи з протонними числами 12 і 15. Який з даних елементів має яскравіше виражені металічні властивості? Чому? Запишіть електронно-графічні формули будови атомів цих елементів у основному та збудженому станах. Укажіть можливі ступені окиснення у сполуках. Складіть рівняння реакції між речовинами, утвореними цими елементами.
4. «Практичність теорії»
На прикладі будови атома Калію та Хлору поясніть, чому одні елементи мають постійні ступені окиснення, а інші змінні.
5. «Дивуй»
Елемент, якому відповідає вищий оксид із загальною формулою R2О5 , утворює летку сполуку з Гідрогеном, масова частка Гідрогену в якому становить 3,85 %. Що це за елемент? Складіть електронні схеми будови цього елемента в основному та збудженому станах. Вкажіть можливі ступені окиснення.
VIII. Підбиття підсумків уроку.
15.02.2023
Тема:" Електронні оболонки , будова 1-3 періодів, хмара,орбіталь, рівні, підрівні, радіус атома" - перейти за посиланням , опрацювати конспект уроку в зошит., або параграф 3 ст.18-22
https://narodna-osvita.com.ua/4819--9-budova-elektronnih-obolonok-atomv-hmchnih-elementv-radus-atoma.html - посилання на конспект уроку.
16.2.2023
Тема:"Основний стан , збуджений, спарені та неспарені електрони" - опрацювати відео урок .Виписати головне
https://www.youtube.com/watch?v=8O2xyNtFI-M х- поси лання на відео урок
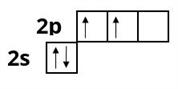
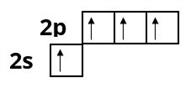
21.02.2023
Теорія окиснювально-відновних процесів
План
7.1 Ступінь окиснення елементів
7.2 Основні поняття: окисник, відновник, окиснення, вiдновлення. Активні окисники i відновники
7.3 Типи окиснювально-відновних реакцій
7.4 Складання рівнянь ОВР. Еквіваленти речовин
7.5 Гальванічні елементи. Електрохімічний ряд напруг металів. Стандартні потенціали окисників i відновників
7.6 Напрямок ОВР
7.1 Ступінь окиснення елементів
Ступінь окиснення – це умовний заряд атома, якого він набуває, якщо віддає або приєднує електрони, розрахований виходячи з припущення, що сполука складається iз йонів і в цілому є електронейтральною.
Для знаходження ступеня окислення користуються наступними правилами :
1. Ступінь окиснення елементів в простих речовинах дорівнює нулю.
2. Ступінь окиснення Гідрогену дорівнює +1, за винятком гідридів – -1, наприклад : NaH.
3. Ступінь окиснення Оксигену дорівнює -2, за винятком пероксидів – Н2О2 (ст. ок. = -1); надпероксидів – KO2 (ст. ок. = -1/2); озонідів – KO3 (ст. ок. = -І/3); дифториду Оксигену – OF2 (ст. ок. = +2).
4. Ступінь окиснення лужних металів завжди дорівнює +1, лужноземельних +2.
Існують елементи для яких характерний тільки один ступінь окиснення. Але в більшості випадків елементи мають декілька ступенів окиснення. Так наприклад, ступінь окиснення Мангану в сполуках дорівнює: ![]() ,
, ![]() ,
, ![]()
![]() .
.
У багатьох випадках значення ступеня окиснення елемента не співпадає з числом утворених зв'язків. Наприклад:
![]()
![]()
![]()
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]()
Визначити ступінь окиснення можна за номером групи періодичної системи хімічних елементів, в якій знаходиться елемент.
Вищий ступінь окиснення, відповідає номеру групи. Наприклад: ![]() ,
, ![]() ,
, ![]()
![]() та ін.
та ін.
Винятком є F, O, Не, Nе, Аг, Fе, Со, Ni, вищий ступінь окиснення яких нижчий, ніж відповідний номер групи. Елементи Сu, Аg, Аu мають вищий ступінь окиснення +3, хоча вони належать до першої групи. Наприклад: ![]() ,
, ![]() ,
, ![]() .
.
Нижчий ступінь окиснення елемента визначається за різницею номера групи, в якій знаходиться елемент і восьми. Наприклад, Нітроген має мінімальний ступінь окиснення –3 (5 – 8 = -3).
Нижчий ступінь окиснення визначає відновні властивості елемента, вищий – окиснювальні, а проміжний характеризує двоїсту природу елемента.
7.2 Основні поняття: окисник, відновник, окиснення, відновлення. Активні окисники і відновники
Зміна ступеня окиснення елемента пов’язана зі зміною електронної структури частинок: віддаванням або приєднанням електронів.
Процес віддавання електронів супроводжується підвищенням ступеня окиснення і називається окисненням.
Процес приєднання електронів супроводжується зниженням ступеня окиснення і називається відновленням.
Реакції, які супроводжуються зміною ступенів окиснення елементів називаються окисно-відновними (редокс-реакціями). Під час цих реакцій відбуваються два процеси: окиснення і відновлення.
Частинки, які приєднують електрони – окисники (акцептори електронів); частинки, які віддають електрони – відновники (донори електронів). Таким чином, у цьому випадку має місце окисно-відновна рівновага:
Ох1+ Red2 ![]() Ox2 + Red1
Ox2 + Red1
Для реакції:
CuSO4 + Fe ![]() FeSO4 + Cu
FeSO4 + Cu
окисник – Cu2+, відновник – Fe.
Cu2+ + 2![]()
![]() Cu° – процес відновлення
Cu° – процес відновлення
Fe° – 2![]()
![]() Fe2+ – процес окиснення,
Fe2+ – процес окиснення,
або сумарне рівняння Cu2+ + Fe°![]() Fe2+ + Cu°
Fe2+ + Cu°
Великий вклад у розвиток теорії окисно-відновних процесів внесли Л.В. Писаржевський, Я.Л. Михайленко, М.О. Шилов, Г.В. і С.В. Дайни та ін.
Всі речовини за їх здатністю до окиснення чи відновлення поділяються на три групи:
І – безумовні окисники – речовини, які можуть тільки відновлюватися (приймати електрони). До них належать прості речовини, утворені елементами, що характеризуються великими значеннями електронегативності, наприклад: F2, O2, Cl2. Складні речовини є безумовними відновниками тільки тоді, коли до їх складу входить елемент з вищим ступенем окиснення (![]() ,
, ![]() ). Складні йони (аніони) що містять елементи з вищим або високим ступенем окиснення: MnO
). Складні йони (аніони) що містять елементи з вищим або високим ступенем окиснення: MnO![]() , Cr2O
, Cr2O![]() , SO
, SO![]() та ін., вони відновлюються за схемами рівнянь:
та ін., вони відновлюються за схемами рівнянь:
MnO![]() + 8H
+ 8H![]() +5
+5![]()
![]() Mn2
Mn2![]() + 4Н2О
+ 4Н2О
MnO![]() + 2H2O +3
+ 2H2O +3![]()
![]() MnO2 + 4OH
MnO2 + 4OH![]()
MnO![]() + 1
+ 1![]()
![]() MnO
MnO![]()
Cr2O![]() + 14H
+ 14H![]() + 6
+ 6![]()
![]() 2Cr
2Cr![]() + 7H2O
+ 7H2O
Cr2O![]() + 7H2O + 6
+ 7H2O + 6![]()
![]() 2Cr(OH)3 + 8OH
2Cr(OH)3 + 8OH![]()
SO![]() + 4H
+ 4H![]() + 2
+ 2![]()
![]() SO2 + 2H2O
SO2 + 2H2O
SO![]() + 8H
+ 8H![]() + 6
+ 6![]()
![]() S + 4H2O
S + 4H2O
В залежності від концентрації кислоти-окисника (концентрована H2SO4, HNO3) і сили відновника, процес відновлення може відбуватися за схемами:
SO![]() → SO2 → S → H2S
→ SO2 → S → H2S
NO![]() → NO2 → NO → N2O → N2→ NH3 (NH
→ NO2 → NO → N2O → N2→ NH3 (NH![]() )
)
![]()
концентрація HNO3 знижується
ІІ – безумовні відновники – речовини, здатні віддавати електрони. Це можуть бути прості речовини – метали (найбільш активні лужні та лужно-земельні), та неметали – водень і вуглець; складні сполуки, що містять елементи з мінімальним ступенем окиснення (NH3, H2S, KJ, CO, NH3, As2S3); прості йони (катіони) з нижчим ступенем окиснення елементів: Fe2+, Cu+, Sn2+, Cr![]() ,Ті2+; прості аніони з нижчим ступенем окиснення елементів: J
,Ті2+; прості аніони з нижчим ступенем окиснення елементів: J![]() > Br
> Br![]() > Cl
> Cl![]() , S
, S![]() , N3
, N3![]() (нітридний Нітроген).
(нітридний Нітроген).
Деякі схеми окиснення відновників:
H2S – 2![]()
![]() S + 2Н+
S + 2Н+
H2S + 4H2O – 8![]()
![]() SO
SO![]() +10H+
+10H+
Sn2+-2![]()
![]() Sn+4
Sn+4
Cr3+ + 8OH![]() – З
– З![]()
![]() CrO
CrO![]() + 4H2O
+ 4H2O
ІІІ – сполуки, які можуть проявляти властивості як окисників, так і відновників залежно від умов.
Наприклад:
![]() – окисник, може тільки приймати електрони;
– окисник, може тільки приймати електрони;
![]() – відновник;
– відновник;
![]() – двоїста природа, може бути і окисником, і відновником:
– двоїста природа, може бути і окисником, і відновником:
2![]() + O2
+ O2 ![]() 2
2![]()
![]() + 2
+ 2![]()
![]() 3S° + 3H2О
3S° + 3H2О
7.3 Типи окиснювально-відновних реакцій
Розрізняють такі типи окиснювально-відновних реакцій:
а) міжмолекулярні реакції, які відбуваються між різними молекулами (найбільш широка група реакцій):
2![]() + C12°
+ C12°![]() 2
2![]()
б) внутрішньомолекулярні реакції, які відбуваються зі зміною ступеня окиснення різних атомів однієї й тієї ж молекули (це, головним чином, реакції термічного розкладу речовин):
2![]()
![]() 2Hg° + O2
2Hg° + O2
![]()
![]()
![]() + N2° + 4H2O
+ N2° + 4H2O
в) реакції самоокиснення-самовідновлення (диспропорціонування) – перебігають з одночасним збільшенням і зменшенням ступеня окиснення одного й того ж елемента:
![]() +
+ ![]() + H2O →
+ H2O → ![]() +
+ ![]() .
.
Внутрішньомолекулярні реакції окиснення-відновлення, в ході яких відбувається вирівнювання ступеня окиснення одного й того ж елемента, є процесами контрдиспропорціонування (комутації):
![]() .
.
22.02.2023
Продовження теми "Електронегативність ступінь окиснення вищий, нижчий , основний "
7.4 Методики складання рівнянь окисно-відновних реакцій. Еквіваленти речовин
Для розрахунку коефіцієнтів ОВР використовують два методи: метод електронного балансу та йонно-електронний. Обидва методи базуються на одних і тих же положеннях: в ОВР загальне число електронів, що віддає відновник, дорівнює загальному числу електронів, які приєднує окисник. Причому, трактування окисно-відновного процесу як простого переходу електронів – це лише зручний спосіб для написання рівняння реакції і підбору коефіцієнтів. Наприклад:
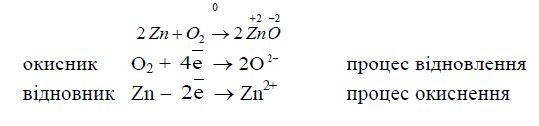
Чисто формальним є те, що Цинк втрачає два електрони, а Оксиген їх приєднує, тому що йонів О![]() взагалі бути не може у вільному вигляді, особливо поряд з катіонам. В дійсності зв'язок між Цинком і Оксигеном в молекулі ZnO – полярний, де
взагалі бути не може у вільному вигляді, особливо поряд з катіонам. В дійсності зв'язок між Цинком і Оксигеном в молекулі ZnO – полярний, де ![]() , що приблизно вдвічі менше за ступінь окиснення +2.
, що приблизно вдвічі менше за ступінь окиснення +2.
Метод електронного балансу ґрунтується на підрахунку числа приєднаних або втрачених електронів, проводиться виходячи із значень ступенів окиснення елементів до і після реакції.
Наприклад для реакції:
![]() +
+ ![]() + H2SO4 →
+ H2SO4 → ![]() +
+ ![]() + Na2SO4 + H2O
+ Na2SO4 + H2O
Ступінь окиснення змінюють тільки Манган і Сульфур.
Переходу Mn![]() → Mn
→ Mn![]() формально відповідає приєднання п'яти електронів, а переходу S
формально відповідає приєднання п'яти електронів, а переходу S![]() → S+6 – втрата двох електронів. Отже, KMnO4 – окисник, a Na2SO3 – відновник. Баланс "електронного обміну" такий:
→ S+6 – втрата двох електронів. Отже, KMnO4 – окисник, a Na2SO3 – відновник. Баланс "електронного обміну" такий:
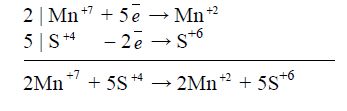
Знайдені коефіцієнти (множники) переносять в рівняння реакції:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 3H2O
Інші коефіцієнти знаходять за підрахунком балансу інших елементів: за SO![]() визначають число молекул сульфатної кислоти (три), а за балансом атомів Гідрогену визначають число молекул води (три).
визначають число молекул сульфатної кислоти (три), а за балансом атомів Гідрогену визначають число молекул води (три).
Розглянуті операції здійснюють без багаторазового переписування рівняння реакції,
Для спрощення можна також використати наступний спосіб підбору коефіцієнтів:
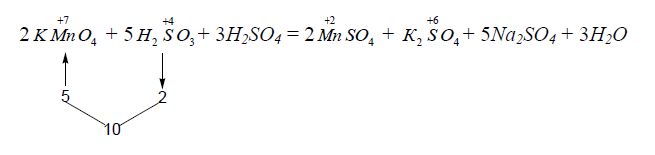
Йонно-електронний метод ґрунтується на складанні окремих рівнянь реакцій відновлення і окиснення (напівреакцій), які потім сумують в загальне рівняння. Дотримуються наступних правил:
1. Сильні електроліти записуються у вигляді йонів.
2. Неелектроліти, слабкі електроліти, гази і осади – у вигляді молекул.
3. Йони, які не змінюються в ході реакції, в йонну схему не включаються.
4. Напівреакція повинна бути урівняна за кількістю всіх атомів елементів, що приймають в ній участь. Для цього враховують наступне:
а) у кислому середовищі урівнювання Оксигену здійснюють шляхом додавання води в ту частину напівреакції, де Оксигену не вистачає, в кількості, що дорівнює його нестачі, а до протилежної частини додають Н![]() -йони , в кількості в два рази більшій, ніж добавленої води (2Н+→Н2О, або Н2О→2Н+). Наприклад:
-йони , в кількості в два рази більшій, ніж добавленої води (2Н+→Н2О, або Н2О→2Н+). Наприклад:
SO![]() + H2O – 2
+ H2O – 2![]() → SO
→ SO![]() + 2H
+ 2H![]()
SO![]() + 6H
+ 6H![]() + 4
+ 4![]() → S + 3H2O;
→ S + 3H2O;
б) у лужному середовищі урівнювання Оксигену здійснюють за допомогою гідроксидних груп ОН![]() і води. Якщо Оксигену не вистачає – додають ОН
і води. Якщо Оксигену не вистачає – додають ОН![]() -групи в кількості у два рази більшій, ніж не вистачає Оксигену, а в протилежній частині отримують воду (Н2О→2ОН
-групи в кількості у два рази більшій, ніж не вистачає Оксигену, а в протилежній частині отримують воду (Н2О→2ОН![]() , або 2ОН
, або 2ОН![]() →Н2О). Наприклад:
→Н2О). Наприклад:
MnO![]() + 2H2O + 3
+ 2H2O + 3![]() → MnO2 + 4OH
→ MnO2 + 4OH![]()
SO![]() + 2OH
+ 2OH![]() – 2
– 2![]() → SO
→ SO![]() + H2O
+ H2O
в) у нейтральному середовищі – у ліву частину напівреакції як на надлишок, так і на нестачу Оксигену додають тільки воду (Н2О → 2ОН![]() , або Н2О → 2Н+). Наприклад:
, або Н2О → 2Н+). Наприклад:
MnO![]() + 2H2O + 3
+ 2H2O + 3![]() → MnO2 + 4OH
→ MnO2 + 4OH![]()
Мn![]() + 2H2O – 2
+ 2H2O – 2![]() → MnO2 + 4H
→ MnO2 + 4H![]()
Реакції окиснення-відновлення, що відбуваються в кислому середовищі розглянемо на такому прикладі:
Молекулярна схема:
KMnO4 + Na2SO3 + H2SO4 = MnSO4 + K2SO4 + Na2SO4 + H2O
Йонна схема реакції:
MnO![]() +SO
+SO![]() + Н
+ Н![]() → Mn2+ + SO
→ Mn2+ + SO![]() + Н2О
+ Н2О
Напівреакції:
SO![]() – відновлена форма
– відновлена форма![]() SO
SO![]() – окисна форма
– окисна форма
MnO![]() – окисна форма
– окисна форма![]() Mn2+ – відновлена форма
Mn2+ – відновлена форма
Процес окиснення:
SO![]() → SO
→ SO![]()
1) урівнюють кількість атомів Сульфуру в лівій і правій частинах напівреакції (у даному випадку не потрібно);
2) урівнюють кількість атомів Оксигену (див. вище):
SO![]() + H2O → SO
+ H2O → SO![]() + 2H
+ 2H![]()
3) урівнюють заряд: для балансу зарядів в лівій частині рівняння необхідно відняти два електрони:
SO![]() + H2O – 2
+ H2O – 2![]() → SO
→ SO![]() + 2H
+ 2H![]()
Процес відновлення:
MnO![]() → Mn2+
→ Mn2+
1) урівнюють кількість атомів Мангану (у даному випадку не потрібно);
2) урівнюють кількість атомів Оксигену:
MnO![]() +8Н
+8Н![]() → Mn2+ + 4Н2О;
→ Mn2+ + 4Н2О;
3) урівнюють заряд: для балансу зарядів в лівій частині рівняння необхідно додати п'ять електронів:
MnO![]() +8Н
+8Н![]() + 5
+ 5![]() → Mn2+ + 4Н2О;
→ Mn2+ + 4Н2О;
4) складають обидві напівреакції, перемноживши їх на додаткові множники для балансу електронів:
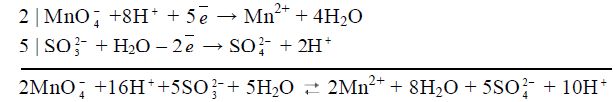 .
.
Вірність розрахунку коефіцієнтів перевіряють за числом зарядів, яке повинно бути рівним у лівій і правій частинах рівняння (в даному випадку +6=+6);
5) скорочують однакові йони і молекули (у даному випадку Н+ і Н2О) у лівій і правій частинах рівняння і записують рівняння у молекулярному вигляді таким чином:
2KMnO4 + 5Na2SO3 + 3H2SO4 ![]() 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
На практиці користуються спрощеною схемою (без багаторазового переписування рівнянь напівреакцій).
23.02.2023
Повторення вивченої теми " Періодичний закон і періодична система хімічних елементів Д.І Менделєєва"
28.02.2023
Користуючись схемою на прикладі Сульфуру складіть характеристику хімічного елементу Магнію та Брому
Користуючись планом характеристики хімічного елемента, схарактеризуйте елемент №16.
Характеристика Сульфуру за його положенням у ПС
І. Назва елемента, його символ, відносна атомна маса.
Сульфур - S , Ar = 32
ІІ. Положення у Періодичній системі:
Порядковий номер 16
S знаходиться у ІІІ малому періоді, VІ групі, головній підгрупі
ІІІ. Будова атомаS:
1.Заряд ядра +16
кількість протонів 16, нейтронів 16
2. Кількість електронів 16.
3. Кількість електронних шарів (енергетичних рівнів ) 3.
4. Кількість електронів на зовнішньому рівні 6, шар незавершений.
5. Схема будови атома, електронна формула (конфігурація) , графічна електронна формула. Кількість спарених і неспарених електронів.Можливі валентності.
16S)))+16S 1s22s22p63s23p4
2е 8е 6е
|
|
|
|
|
|
|
|
|
| ||||||
|
|
|
|
| 3S2 | 3P6 | 3d0 |
|
| ||||||
| 2S2 | 2P6 | ↑↓ | ↓↑ | ↑ | ↑ |
|
|
|
|
|
|
| ||
1S2 | ↑↓ | ↓↑ | ↑↓ | ↓↑ |
|
|
|
|
|
|
|
|
|
|
|
↓↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14 електронів спарених, 2електрона неспарені.
Валентність ІІ, 4,6
ІV. Характер хімічного елемента:
s-елемент;неметалічний елемент
V. Назва та формула простої речовини.
СіркаS - неметал
VІ. Характер сполук хімічного елемента
Вищий оксид: SО3 сульфур (VІ )оксид, виявляє кислотні властивості
Гідрат вищого оксиду : Н2SО4 сульфатна кислота
А також існує оксид SО2 сульфур (ІV)оксид , виявляє кислотні властивості
Йому відповідає сульфітна кислота Н2SО3
Летка сполука з Гідрогеном Н2S
VІІ.Порівняння неметалічних властивостей із властивостями елементів, що стоять поряд у періоді та групі.
Sпроявляє неметалічні властивості слабше за Сl, але сильніше за Р, оскільки заряд ядра S(+16) менший, ніж у Сl, (+17). більший, ніж у Р (+15) і Тому Sпритягує валентні електрони слабше , ніжСl і сильніше, ніж Р .
S проявляє неметалічні властивості слабше за О, але сильніше заSе, оскільки радіус атома S (3енергетичні рівні) більший, ніж у O (2 енергетичні рівні) і менший, ніж у Sе (4 енергетичних рівні). Тому S притягує валентні електрони слабше за О але сильніше за Sе.
Тема" Тема:"Йонний, ковалентний , металічний, водневий хімічні зв'язки" - опрацювати відео урок, конспект
Тема: Хімічні реакції.
Хімічна рівновага. Принцип ле Шательє
Хід заняття
І. Організаційна частина заняття
Перевірка присутніх. Налаштування студентів на роботу.
ІІ. Перевірка домашнього завдання
«Робота біля дошки». Студенти складають приклади молекулярних та йонних рівнянь реакцій обміну, користуючись таблицями розчинності. Одночасно аналізуються можливі помилки.
ІІІ. Актуалізація опорних знань студентів
Питання до аудиторії:
За якими ознаками характеризують реакції?
Що таке оборотні та необоротні реакції?
Вкажіть типи даних реакцій. Які з них екзотермічні? (Екзотермічні-з виділенням теплоти (ΔН < 0); ендотермічні-з поглинанням теплоти (ΔН > 0).
4КС1O3 → 3КС1O4 +КС1; ΔН = -297 кДж
С2Н4 +Н2→ С2Нб; ΔН = -137,8 кДж
МnO2 + 2С-→ Мn + 2СО; ΔН = +293кДж
2NаОН + Н2SO4 →Na2SO4 + 2Н20; ΔН = -290 кДж
СаСО3-→ СаO+С02; ΔН = +178 кДж
4Р+5O2 -→ 2Р205; ΔН = -3010кДж
Si02 + 2Mg→ 2МgО + Sі; ΔН = -372 кДж
Аs2O3 +O2 →Аs2O5; ΔН = -271 кДж
Прийом «Міні практикум». Робота зі студентами щодо урівнювання окисно-відновних реакцій методом електронного балансу.
Завдання. Скласти електронний баланс та розставити коефіцієнти в таких окисно-відновних процесах:
а) виверження вулкана з утворенням сірки:
H2S + O2 → H2O + S;
H2S + SO2 → H2SO4 + S;
б) зв’язування атмосферного азоту киснем під час грозових розрядів:
N2 + O2 → NO;
NO + O2 → NO2;
NO + H2O → HNO3 + HNO2;
в) потемніння срібних речей:
Ag + H2S + O2 → Ag2S + H2O;
г) знезараження овочесховищ:
H2S + O2 → S + H2O;
S + O2 → SO2.
д) відновлення заліза з його оксиду (виплавлення чавуну):
Fe2O3 + H2 → Fe + H2O.
IV. Повідомлення теми, мети та завдань заняття
V. Мотивація навчальної діяльності студента
Окисно-відновні процеси – одні з найважливіших процесів природи. Ці реакії належать до числа найбільш розповсюджених хімічних реакцій й мають величезне значення в теорії і практиці. До них належать:
основні процеси життєдіяльності – дихання та обмін речовин у живих організмах, гниття й бродіння, фотосинтез у зелених частинах рослин.
основні процеси в природі: колоообіг елементів у природі, процеси корозії, згоряння речовин, виверження вулкана з утворенням сірки, зв’язування атмосферного азоту киснем під час грозових розрядів, потемніння срібних речей;
основні процеси чорної та кольорової металургії: добування металів, кислот, лугів, амоніаку, та багато інших цінних продуктів, електрохімічне виробництво.
перетворення хімічної енергії на електричну чи теплову енергію продуктів згоряння.
процеси, що відбуваються в гальванічних елементах і акумуляторах.
на окисно-відновних реакціях засновані методи об’ємного аналізу в аналітичній хімії.
природоохоронні заходи, боротьба із шкідниками сільського господарства, знезараження овочесховищ та інше; очищення різних речовин, природних і стічних вод, газових викидів.
Стан хімічної рівноваги за сталих умов може зберігатися будь-який час, а це не вигідно у промисловості. Тому вчені працювали над способами зміщення хімічної рівноваги у певному напрямку. Способи зміщення рівноваги у бажаному напрямку відіграють величезну роль у хімії. Багато промислових процесів було освоєно завдяки застосуванню способів зміщення рівноваги в напрямку, що забезпечує високий вихід речовини, яку одержують.
VІ. Формування нових знань
Вам уже відомо, що хімічні реакції, які відбуваються в одному напрямку, називають необоротними. Більшість хімічних процесів є оборотними, оскільки за одних і тих самих умов відбуваються і пряма, і зворотна реакції (особливо в замкнених системах).
Наприклад:
А![]() ) реакція, рівняння якої у відкритій системі необоротна;
) реакція, рівняння якої у відкритій системі необоротна;
Б![]() ) ця сама реакція, рівняння якої у замкненій системі оборотна.
) ця сама реакція, рівняння якої у замкненій системі оборотна.
Під час оборотних реакцій у системі присутні як реагенти, так і продукти реакції. Співвідношення між ними змінюється тільки при зміні умов (температури, тиску, концентрації).
Типовим прикладом необоротної реакції є розклад калій хлорату за наявності
к![]() аталізатора:
аталізатора:
Адже добути калій хлорат KClO3 сполученням калій хлориду і кисню неможливо за будь-яких умов.
Якщо реакція оборотна, то початкові концентрації реагуючих речовин поступово зменшуються, швидкість прямої реакції також зменшується. Однак поява продуктів уможливлює перебіг зворотної реакції. З часом концентрації продуктів реакції збільшуються, як і швидкість зворотної реакції. Зрештою досягається такий стан, за якого швидкість прямої і зворотної реакцій стають однаковими:![]()
Зміна концентрацій речовин (а) і швидкостей (б) оборотної реакції у системі Н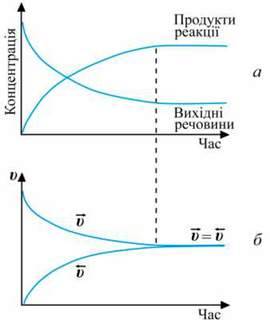 2 + І2 -› 2НІ з часом представлена графічно.
2 + І2 -› 2НІ з часом представлена графічно.
Стан реакційної системи, за якого швидкість прямої реакції дорівнює швидкості зворотної реакції, називають хімічною рівновагою.
При цьому концентрації реагуючих речовин і продуктів реакції не змінюються. Їх називають рівноважними концентраціями.
На макрорівні здається, що нічого не відбувається. Насправді прямий і зворотний процеси тривають, але з однаковою швидкістю. Тому таку рівновагу в системі називають динамічною.
Стан рівноваги може зберігатися невизначено тривалий час, якщо не змінювати умови, за яких він установлюється.
Перехід системи з одного рівноважного стану в інший називається зміщенням хімічної рівноваги.
На зміщення рівноваги впливають концентрація, температура, тиск. Принцип, що характеризує зміщення рівноваги під впливом зміни зовнішніх умов, сформулював французький учений Ле Шательє (1884):
якщо на рівноважну систему справляти будь-який вплив, то хімічна рівновага зміщуватиметься в бік тієї реакції, яка послаблює цей вплив.
якщо змінити одну з умов, за яких система перебуває в рівновазі - температуру, тиск чи концентрацію речовин, - то рівновага зміщується в напрямку тієї реакції, яка протидіє цій зміні.
За принципом Ле Шательє, напрям зміщення рівноваги можна передбачити. Так, якщо:
збільшується концентрація реагуючих речовин, то хімічна рівновага системи зміщується в бік прямої реакції (утворення продуктів);
збільшується концентрація продуктів реакції, то хімічна рівновага системи зміщується в бік зворотної реакції (утворення початкових речовин);
підвищується тиск, то хімічна рівновага системи зміщується в бік тієї реакції, яка супроводжується зменшенням числа молів газуватих речовин; при зниженні тиску – в бік тієї реакції, яка супроводжується збільшенням числа молів газуватих речовин;
підвищується температура, то хімічна рівновага системи зміщується в бік ендотермічної реакції, за зниження температури – в бік екзотермічного процесу.
суттєво впливають на стан хімічної рівноваги каталізатори. Однак вони не зміщують рівновагу, бо водночас прискорюють як пряму, так і зворотну реакції. Але наявність каталізатора дає змогу пришвидшити встановлення рівноваги, що є важливим для хімічного виробництва.
Висновок
Хімічні реакції бувають необоротними, бо відбуваються тільки в одному напрямку, – в бік утворення продуктів реакції, та оборотними, бо за одних і тих самих умов ідуть у прямому та зворотному напрямах.
Коли швидкості прямої і зворотної реакцій збігаються, настає стан хімічної рівноваги. Він утримується дуже довго, якщо умови не змінюються.
Під впливом зовнішніх умов відбувається зміщення хімічної рівноваги у бік тієї реакції, яка послаблює вплив цих умов (принцип Ле Шательє).
Зміщення хімічної рівноваги можна досягти збільшенням концентрації однієї з реагуючих речовин, підвищенням (або зниженням) температури чи тиску. Застосування каталізаторів лише пришвидшує досягнення стану рівноваги, однак вони не змінюють співвідношення між швидкістю прямої та зворотної реакцій.
Викладач. Розглянемо приклади впливу чинників на рівновагу системи.
Вплив температури
Для оборотної реакції синтезу амоніаку:
N2(г) + 3H2(г) ↔ 2NH3(г); ΔH = −92кДж
Пряма реакція (синтез амоніаку) є екзотермічною реакцією, а зворотна (розклад амоніаку) відповідно ендотермічною.
Підвищення температури зміщує рівновагу в бік проходження ендотермічної реакції, а зниження температури - в бік екзотермічного процесу.
Отже, для цієї реакції з метою зміщення рівноваги праворуч температуру потрібно знижувати.
Вплив тиску
При підвищенні тиску збільшується кількість молекул в одиниці об'єму газової суміші. Та з реакцій (пряма чи зворотна), яка відбувається за участі більшої кількості молекул газоподібних речовин, протікає швидше. Відбувається зміна швидкостей реакцій, і, нарешті, знову наступає хімічна рівновага.
Зауважимо, що реакція, яка відбувається зі збільшенням кількості молекул газів, приводить до підвищення тиску в системі, а реакція, що відбувається зі зменшенням кількості молекул газів, - до зниження тиску.
Отже, при підвищенні тиску рівновага зміщується в бік зменшення кількості молекул газоподібних речовин, тобто в бік зниження тиску. А при зниженні тиску рівновага зміщується в бік зростання кількості молекул газоподібних речовин, тобто в бік підвищення тиску.
У наведеному вище прикладі синтезу амоніаку у лівій частині маємо чотири об'єми газу, а в правій - два:
N2(г) + 3H2(г) ↔ 2NH3(г); ΔH=−92 кДж
підвищення тиску приведе до зміщення рівноваги праворуч.
якщо ж під час реакції загальна кількість молекул (а отже, й об'єм) газоподібних речовин не змінюється, стан рівноваги від зміни тиску не залежить.
Вплив концентрації
Якщо в рівноважну систему вводиться будь-яка речовина, що бере участь у реакції (концентрація збільшується), то рівновага зміщується в бік тієї реакції, під час проходження якої дана речовина витрачається.
Якщо ж з рівноважної системи виводиться речовина, то рівновага зміщується в бік тієї реакції, при перебігу якої дана речовина утворюється.
Так, наприклад, для реакції
2SO2(г) + O2(г) ↔ SO3(г)
з метою зміщення рівноваги праворуч (у бік прямої реакції) необхідно в рівноважну суміш вводити SО2 і О2, тобто збільшувати їхні концентрації і виводити з рівноважної суміші, зменшувати концентрацію SО3.
Гальванічний елемент
Процеси окиснення і відновлення, які завжди відбуваються одночасно, можна провести за відсутності безпосереднього контакту між відновником та окисником, тобто в умовах просторового їх розділення. При цьому електрони переходять від відновника до окисника не безпосередньо, а через металічний провідник, створюючи електричний струм.
Гальванічні елементи – пристрої, призначені для безпосереднього перетворення енергії хімічної реакції на електричну.
Г![]() альванічний елемент Даніеля – Якобі складається з цинкової пластини, зануреної у розчин, та мідної пластини, зануреної у розчин
альванічний елемент Даніеля – Якобі складається з цинкової пластини, зануреної у розчин, та мідної пластини, зануреної у розчин ![]() Розчини електролітів (
Розчини електролітів (![]() ,
,![]() ) розділяють електрохімічним ключем, який перешкоджає їхньому змішуванню, але забезпечує можливість переходу іонів з одного розчину в інший.
) розділяють електрохімічним ключем, який перешкоджає їхньому змішуванню, але забезпечує можливість переходу іонів з одного розчину в інший.
Я![]() кщо зовнішнє коло розімкнене, цинковий та мідний електроди перебувають у стані рівноваги:
кщо зовнішнє коло розімкнене, цинковий та мідний електроди перебувають у стані рівноваги:
Внаслідок цього на них виникають подвійні електричні шари і певні електродні потенціали. Ці потенціали різні, оскільки здатність віддавати електрони і переходити в розчин цинку та міді не однакова. Більш здатний до віддавання електронів цинк.
Я![]() кщо електроди з’єднати металічним провідником, електрони почнуть переходити з більш негативного цинкового електрода на мідний. Це спричинює зміщення рівноваги.
кщо електроди з’єднати металічним провідником, електрони почнуть переходити з більш негативного цинкового електрода на мідний. Це спричинює зміщення рівноваги.
При замкненому зовнішньому колі в гальванічному елементі окиснюється металічний цинк (утворені іони цинку переходять у розчин), на мідному електроді відбувається відновлення іонів міді (осаджується металічна мідь).
Сумарне рівняння окисно – відновної реакції, яка є джерелом електричного струму:
![]()
Внаслідок перебігу процесів на цинковому електроді катіони![]() переходять у розчин і створюють у ньому надлишковий позитивний заряд, а біля мідного розчин, навпаки, збіднюється на катіони міді
переходять у розчин і створюють у ньому надлишковий позитивний заряд, а біля мідного розчин, навпаки, збіднюється на катіони міді![]() і має негативний заряд (за рахунок аніонів
і має негативний заряд (за рахунок аніонів![]() ). Електричне поле, що виникає, спричинює рух катіонів розчину (
). Електричне поле, що виникає, спричинює рух катіонів розчину (![]() ) до мідного електрода, а аніонів (
) до мідного електрода, а аніонів (![]() ) – від мідного електрода до цинкового. Внаслідок такого переміщення зарядів розчини біля електродів залишаються електронейтральними.
) – від мідного електрода до цинкового. Внаслідок такого переміщення зарядів розчини біля електродів залишаються електронейтральними.
Під час роботи гальванічного елемента електричний струм у зовнішньому колі створюється спрямованим рухом електронів, у внутрішньому – іонів.
У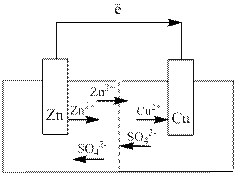 будь-якій електрохімічній системі назви електродів визначають за характером окисно-відновних процесів, які на них відбуваються.
будь-якій електрохімічній системі назви електродів визначають за характером окисно-відновних процесів, які на них відбуваються.
Анод-електрод, на якому відбувається процес окиснення і який надсилає електрони в зовнішнє коло елемента.
У гальванічному елементі він має негативний заряд.
Катод-електрод, на якому відбувається процес відновлення, і який приєднує електрони. У гальванічному елементі він має негативний заряд.
Схема роботи гальванічного елемента Даніеля – Якобі:
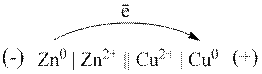
Електрорушійна сила (![]() ) – сила, завдяки якій відбувається переміщення електронів у зовнішньому колі елемента. Для точного вимірювання ЕРС гальванічного елемента потрібні спеціальні пристрої і такі умови, щоб у ньому практично не створювався електричний струм. Корисна робота, яку можна виконати за рахунок енергії хімічної реакції, залежить від її швидкості: вона максимальна в разі повільного, оборотнього перебігу реакції.
) – сила, завдяки якій відбувається переміщення електронів у зовнішньому колі елемента. Для точного вимірювання ЕРС гальванічного елемента потрібні спеціальні пристрої і такі умови, щоб у ньому практично не створювався електричний струм. Корисна робота, яку можна виконати за рахунок енергії хімічної реакції, залежить від її швидкості: вона максимальна в разі повільного, оборотнього перебігу реакції.
Отже, корисна робота гальванічного елемента залежить від сили струму, який від нього відбирають. Цього досягають збільшенням опору вимірювального приладу. Тоді силу струму можна зменшити до мінімуму, швидкість реакції буде нескінченно малою, корисна робота – максимальною.
VIІ. Захист навчальних проєктів
Гальванічний елемент з картоплі, лимону.
Види і принципи роботи малих джерел електричного струму, їх утилізація.
VІIІ. Застосування знань та формування вмінь
Приклад. Поміркуйте, в який бік зміститься рівновага реакції.
CO(г) + H2O(г) ↔ СO2(г) + H2(г) ; ΔH = −42,6 кДж
якщо:
а) збільшити температуру;
б) зменшити концентрацію вуглекислого газу СО2;
в) збільшити тиск у системі.
Відповідь:
а) пряма реакція є екзотермічною, а зворотна - ендотермічною. Підвищення температури зміщує рівновагу в бік ендотермічної реакції, тобто ліворуч;
б) зменшення концентрації вуглекислого газу приведе до зміщення рівноваги в бік реакції його утворення, тобто праворуч;
в) рівняння реакції показує, що один об'єм CO реагує з одним об'ємом водяної пари (разом два об'єми), утворюючи 1 об'єм CO2 і 1 об'єм H2 (також два об'єми). Отже, кількість молекул газоподібних речовин у системі не змінюється і підвищення чи зниження тиску не приведе до зміщення рівноваги.
ІХ. Підведення підсумків заняття
Прийом «Рефлексія». Студенти завершують запропоновані речення, підсумовуючи свої враження після заняття.
Сьогодні на занятті я:
Згадав(ла)…
Почув(ла) уперше…
З’ясував(ла)…
Зрозумів(ла)……
Звернув(ла) увагу на…
РОЗРАХУНКОВІ ЗАДАЧІ НА ОБЧИСЛЕННЯ ЗА ХІМІЧНИМИ РІВНЯННЯМИ ВІДНОСНОГО ВИХОДУ ПРОДУКТУ РЕАКЦІЇ
Опанувавши матеріал параграфа, ви зможете:
пояснювати алгоритм розв'язування задач на обчислення за хімічними рівняннями відносного виходу продукту реакції;
обчислювати за хімічними рівняннями відносний вихід продукту реакції, обґрунтовуючи обраний спосіб розв'язання;
висловлювати судження щодо значення вмінь розв'язувати задачі.
Розв'язування розрахункових задач розвиває вміння аналізувати й синтезувати, порівнювати й обчислювати. Задачі є засобом розвитку інтелекту, критичного та творчого мислення, розв'язання проблем тощо. Вивчаючи хімію, ви ознайомилися з різними типами задач, які не тільки дають змогу проводити обчислення, а й відіграють значну роль у виробничих процесах, сприяють більш рентабельному використанню сировини та продукції. Однак за допомогою розрахунків не завжди отримують такий самий результат, що й на виробництві, оскільки під час добування того чи іншого продукту можливі втрати. Тому практичний вихід продукту завжди менший від теоретично можливого, тобто того, що ми отримуємо, розв'язуючи задачі за хімічними рівняннями.
Теоретичний вихід відповідає масі або об'єму речовини, що знаходимо за рівнянням реакції, а практичний — це маса або об'єм, що отримують під час виробництва. Щоб знайти відносний вихід продукту, який позначають грецькою літерою η (етa), доцільно застосувати формули:

Отже, учимося розв'язувати задачі на обчислення за хімічними рівняннями відносного виходу продукту реакції.
Задача 1. Амоніак об'ємом 6,72 л (н. у.) повністю ввібрався розчином сульфатної кислоти до утворення середньої солі. Утворився амоній сульфат масою 17,82 г. Обчисліть відносний вихід продукту.

Задача 2. Ортофосфатну кислоту повністю нейтралізували натрій гідроксидом та отримали середню сіль масою 32,8 г, з відносним відходом продукту 80 %. Обчисліть маси вихідних речовин.


Задача 3. Етен масою 60 г прореагував з хлором з утворенням дихлороетану масою 198 г. Обчисліть відносний вихід продукту й об'єми газів (н. у.), що прореагували.


22.03.2023
Урок 36
Тема:" Гідроліз солей . Поняття про гальванічний елемент як хімічне джерело електричного труму" - опрацювати відео урок
https://www.youtube.com/watch?v=GLldm1vXswg - посилання на відео урок
22.03.2023
Контрольна робота вивчених знань з теми " Хімічні реакції"
https://naurok.com.ua/test/join?gamecode=8351087 - посилання на контрольну роботу

Комментариев нет:
Отправить комментарий